- RESPIRATOIRE (APPAREIL) - Physiologie
- RESPIRATOIRE (APPAREIL) - PhysiologieLa physiologie de la respiration est l’étude des mécanismes, nombreux et complexes, qui permettent de transporter du milieu ambiant jusqu’aux cellules une quantité adéquate d’oxygène et de rejeter dans l’atmosphère le dioxyde de carbone produit par le métabolisme. Les échanges gazeux entre les poumons et l’air ambiant sont assurés par la ventilation pulmonaire; puis la diffusion alvéolo-capillaire permet les échanges gazeux entre les poumons et le sang. La circulation sanguine se charge de transporter l’oxygène aux différentes cellules de l’organisme (cf. appareil CIRCULATOIRE, SANG). Au niveau des cellules, il existe, d’une part, un nouveau mécanisme de diffusion entre le liquide interstitiel qui les baigne et les vaisseaux capillaires et, d’autre part, une dernière diffusion de gaz entre le liquide interstitiel et l’intérieur des cellules. C’est là que se déroulent les réactions biochimiques d’oxydoréduction productrices d’énergie à partir des substrats organiques nutritifs qui sont finalement minéralisés avec formation d’eau et de dioxyde de carbone. Ce dernier suit un trajet inverse de celui de l’oxygène, qui aboutit à son excrétion pulmonaire.1. Les mécanismes respiratoiresLa ventilation pulmonaireLa ventilation pulmonaire assure la prise d’oxygène dans l’atmosphère ambiante et le rejet de dioxyde de carbone (gaz carbonique).Volumes pulmonairesLors de chaque inspiration, un certain volume d’air entre dans les poumons; lors de l’expiration, un certain volume de gaz, appauvri en oxygène et enrichi en gaz carbonique, est rejeté. Ce volume, inspiré ou expiré à chaque cycle ventilatoire, est appelé le volume courant (Vt ), [avec t pour tide , «marée» en anglais]. Ce dernier étant mobilisé f fois par minute (f : fréquence respiratoire), il devient alors possible de calculer le débit ventilatoire (face="EU Updot" 欄e ), défini comme le nombre de litres de gaz expirés (Ve ) par minute. Il doit être exprimé dans les conditions de pression, de température et de saturation en eau qui règnent dans les poumons humains, c’est-à-dire à 37 0C, à la pression barométrique du lieu déterminé, à la pression saturante de vapeur d’eau, qui est de 47 mm Hg (à 37 0C, 1 mm Hg):
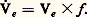 Dans les conditions de repos, le volume courant représente une petite fraction du volume de gaz contenu dans les poumons. Pour étudier l’ensemble des volumes pulmonaires, il faut connecter les voies aériennes d’un sujet à un spirographe où les inspirations s’inscrivent vers le haut et les expirations vers le bas (fig. 1). Lorsque le sujet respire calmement, on enregistre aussi une série de volumes courants de repos. Si on demande au sujet d’effectuer une inspiration forcée, un volume, dépassant le volume courant, s’enregistre: c’est le volume de réserve inspiratoire (Vri ). Si on demande une expiration maximale, on enregistre de manière analogue un volume de réserve expiratoire (Vre ). Lorsque les besoins ventilatoires augmentent, le volume courant s’accroît aux dépens des volumes de réserve expiratoire et surtout inspiratoire. Au terme d’une expiration maximale, un certain volume de gaz impossible à expirer reste dans les poumons: c’est le volume résiduel (Vr ). Pour le mesurer, il faut avoir recours à un procédé indirect. On introduit dans le spiromètre un volume v d’hélium pur, gaz inerte non toxique et peu diffusible à l’intérieur de l’organisme. Après une dizaine de minutes, la concentration d’hélium est la même dans le spiromètre et dans les poumons; on détermine la concentration c d’hélium dans le circuit. Par définition, c = v /V, où V est la somme des volumes pulmonaires concernés et du volume du spiromètre qui est connu. Les volumes pulmonaires où l’hélium a diffusé sont le volume résiduel et le volume de réserve expiratoire qu’il est aisé de mesurer directement. Le volume résiduel est ainsi déterminé.Les différents volumes pulmonaires peuvent être groupés entre eux pour réaliser ce qu’on appelle des «capacités». La somme du volume courant et de la réserve inspiratoire représente la capacité inspiratoire (Ci ). La somme de cette dernière avec le volume de réserve expiratoire représente la capacité vitale (Cv): c’est le volume maximal de gaz qui peut être mobilisé entre une inspiration forcée et une expiration forcée. La somme du volume résiduel et du volume de réserve expiratoire représente la capacité résiduelle fonctionnelle (Crf ). À ce niveau, le gaz alvéolaire est en équilibre avec les gaz du sang des capillaires pulmonaires. À chaque cycle ventilatoire, une fraction du volume courant, le volume alvéolaire (Va ), renouvelle la composition des gaz de la capacité résiduelle fonctionnelle. Enfin, la somme de tous les volumes pulmonaires représente la capacité pulmonaire totale (Cpt ). Ces différents volumes et capacités varient d’un individu à l’autre. Des tables donnent les valeurs moyennes de la capacité vitale et du volume résiduel en fonction de la taille du sujet. À taille égale, les volumes pulmonaires de la femme représentent 85 p. 100 de ceux de l’homme. Pour un sujet de taille donnée, les capacités vitale et pulmonaire totale diminuent avec l’âge, alors que le volume résiduel augmente.Mécanique ventilatoireLes déformations de la cage thoracique imposées par les muscles respiratoires rendent possibles l’inspiration et l’expiration des gaz respiratoires.Élasticité thoraciqueLe thorax est une cavité déformable, schématiquement divisible en deux formations élastiques [cf. THORAX]. La paroi externe est formée des os, des muscles, de la peau, etc. Sa face interne est tapissée par le feuillet pariétal de la plèvre. À l’intérieur, les poumons sont tapissés à leur partie superficielle du feuillet viscéral de la plèvre. De fait, les deux feuillets pleuraux sont accolés et représentent l’«espace» pleural, qui est une cavité virtuelle. Si on introduit dans cette cavité une aiguille reliée à un manomètre, on constate qu’au repos la pression intrapleurale est inférieure à la pression atmosphérique. Cette dépression augmente lors de l’inspiration et diminue lors de l’expiration. Si on laisse l’aiguille en communication avec l’atmosphère, de l’air entre dans la cavité pleurale, qui cesse d’être virtuelle: la paroi délimite un volume plus grand, tandis que les poumons se replient sur eux-mêmes, leur volume devenant inférieur au volume résiduel. Cela montre que, chez l’homme intact, il existe entre paroi et poumon des tensions qui s’exercent dans des directions opposées expliquant la dépression pleurale. Toute augmentation du volume pariétal entraîne une augmentation du volume pulmonaire, ce qui crée une différence de pression entre le gaz alvéolaire et l’extérieur, d’où l’inspiration. L’expiration s’explique de manière analogue.Mécanisme d’augmentation du volume thoraciqueMuscles de l’inspiration . Le thorax est fermé à sa partie inférieure par le diaphragme, muscle fixé sur la colonne vertébrale et sur la face interne des côtes inférieures. Il a une forme convexe vers le haut et repose sur les viscères abdominaux. Sa contraction diminue sa longueur et réduit sa convexité; il en résulte une augmentation de hauteur de la cavité thoracique.La contraction des muscles intercostaux externes , qui s’insérent près de la vertèbre sur la côte supérieure et à distance d’elle sur la côte inférieure, élève l’ensemble des côtes, chacune prenant appui sur la côte sus-jacente. Les côtes étant, lorsqu’on les regarde de face, obliques en bas et en dehors, leur élévation entraîne une augmentation de la largeur du thorax. En outre, vues de profil, les côtes sont obliques en bas et en avant; de ce fait, leur élévation lors de l’inspiration projette le sternum en avant et augmente le diamètre antéro-postérieur du thorax. Ainsi, la contraction des muscles inspiratoires accroît-elle les trois dimensions du thorax, donc son volume. Il en résulte une déformation de la formation élastique sous-jacente des poumons, ce qui crée une dépression dans l’espace alvéolaire et entraîne l’entrée d’air ambiant, donc l’inspiration.Muscles de l’expiration . L’expiration est à l’ordinaire passive: l’arrêt de l’action des muscles inspiratoires permet à l’ensemble élastique thoraco-pulmonaire de reprendre sa position d’équilibre qui correspond au volume pulmonaire de fin d’expiration. Cependant, pour une ventilation importante ou pathologique, l’expiration devient active par la mise en jeu des muscles expirateurs, essentiellement les muscles abdominaux dont la contraction refoule les viscères et le diaphragme vers le haut, réduisant le volume thoraco-pulmonaire.Les échanges gazeuxÉchanges gazeux entre l’atmosphère et l’espace alvéolaireEntre les alvéoles et l’extérieur se trouvent interposées les voies aériennes (bouche, trachée, bronches, bronchioles), qui ne participent pas aux échanges respiratoires et sont appelées de ce fait espace mort anatomique . En effet, en fin d’expiration, ce volume se trouve rempli de gaz alvéolaire; lors de l’inspiration suivante, le sujet inspire d’abord le gaz qui a déjà participé aux échanges, puis l’air pur. De même, au début de l’expiration, l’espace mort contient de l’air ambiant; celui-ci est expulsé avant le gaz alvéolaire. Aux deux phases du cycle ventilatoire, l’espace mort diminue en quelque sorte l’efficacité de la ventilation pulmonaire. Le volume expiré (Ve ) est donc la somme du volume de l’espace mort (Vd ) [avec d pour dead , «mort» en anglais] et du volume alvéolaire (Va ). Seul celui-ci participe aux échanges gazeux. Chez un sujet sain, la composition des gaz respiratoires, qui figure au tableau 1 montre que le gaz expiré est du gaz alvéolaire dilué dans l’air ambiant de l’espace mort. En fait, même chez les sujets sains, un certain nombre d’alvéoles ne participent pas aux échanges respiratoires, parce qu’ils ne sont pas perfusés de sang; leur volume, ajouté à celui des voies aériennes, représente l’espace mort physiologique (150 ml env.).Échanges gazeux alvéolo-capillairesLes alvéoles pulmonaires sont séparés des capillaires pulmonaires par une seule couche de cellules endothéliales, la membrane alvéol-capillaire, dont l’épaisseur est de 1 猪m. La surface d’échanges dépasse 50 mètres carrés. Le passage de l’oxygène vers le sang et du gaz carbonique vers l’alvéole se fait par un mécanisme physique de diffusion des régions de haute pression partielle vers les régions de basse pression.Transport des gaz par le sangLes molécules d’oxygène se dissolvent dans les liquides plasmatique et globulaire du sang. La quantité dissoute est très faible (0,3 ml pour 100 ml de sang) et insuffisante pour assurer les besoins de l’organisme. La plus grande partie de l’oxygène se combine chimiquement à un pigment, l’hémoglobine: 1 gramme d’hémoglobine peut fixer 1,34 ml d’oxygène pur en donnant de l’oxyhémoglobine. Un sang normal, contenant 14 p. 100 d’hémoglobine, se charge donc de 14 憐 1,34 = 18,8 ml d’oxygène. Cette quantité appelée pouvoir oxyphorique du sang, ou capacité totale, est, toutes choses étant égales par ailleurs, fonction de la pression partielle d’oxygène dans le plasma (fig. 2). Pour une pression d’oxygène de 100 mm Hg, le contenu en oxygène sera de 17,9 ml p. 100. La saturation du sang en oxygène est donc égale à (17,9/18,8) 憐 100 = 95 p. 100, valeur habituelle chez le sujet sain. Au niveau des tissus, les pressions d’oxygène étant faibles, l’oxyhémoglobine se dissocie en libérant l’oxygène qui parviendra aux cellules par diffusion.Le gaz carbonique produit au niveau des tissus pénètre par diffusion dans le plasma et les globules. Dans les globules, une enzyme - l’anhydrase carbonique - accélère la formation de bicarbonates en présence d’eau (cf. équilibre ACIDO-BASIQUE). Une partie des bicarbonates formés diffuse vers le plasma. Une fraction du gaz carbonique se combine chimiquement à l’hémoglobine. Le contenu du sang en gaz carbonique est fonction de la pression partielle de ce gaz dans le plasma.De fait, le transport de l’oxygène et du gaz carbonique est facilité réciproquement. Le sang transporte d’autant moins d’oxygène que la pression de gaz carbonique est élevée, ce qui facilite la libération d’oxygène au niveau des tissus (effet Bohr). Par ailleurs, le sang fixe d’autant plus de gaz carbonique que la pression d’oxygène est faible (effet Haldane), ce qui facilite la fixation du gaz carbonique au niveau tissulaire.Échanges gazeux entre le sang et les tissusIl a été établi que c’est au niveau des mitochondries qu’ont lieu les oxydations cellulaires [cf. MÉTABOLISME]. Au voisinage des cellules, la pression partielle de l’oxygène n’est que de quelques mm Hg. Bien que très faible, cette pression est suffisante pour alimenter les réactions biochimiques. De ce fait, par un simple mécanisme de diffusion lié à la différence de pression partielle, l’oxygène traverse la membrane alvéolo-capillaire, le liquide interstitiel, la membrane cellulaire et atteint le cytoplasme. La consommation importante d’oxygène par les mitochondries, d’une part, et la distance relativement grande (à l’echelle cellulaire) entre les capillaires et les mitochondries, d’autre part, expliquent la différence de pression partielle du sang (100 mm Hg) et des mitochondries (quelques mm Hg). Le passage de l’oxygène du sang à travers les capillaires entraîne une baisse de la pression partielle d’oxygène dans le sang et une dissociation de l’oxyhémoglobine (fig. 2).Le gaz carbonique, produit par les oxydations cellulaires, migre, selon un cheminement inverse, des mitochondries vers les capillaires sanguins, par de simples mécanismes de diffusion dus aux différences de pression partielle.La régulation de la respirationNécessité d’une régulationDans la région bulbo-protubérentielle du tronc cérébral, des formations nerveuses, les centres respiratoires , sont à l’origine des influx nerveux responsables de la contraction plus ou moins intense des muscles inspiratoires et expiratoires et, en définitive, de l’intensité de la respiration. Celle-ci doit être adaptée aux besoins de l’organisme: un homme au repos consomme 0,2 litre min-1; au cours d’un exercice musculaire intense, la consommation peut atteindre 4 litres min-1, soit vingt fois plus qu’au repos, ce qui nécessite une adaptation respiratoire et circulatoire. Cela n’est possible que si les centres respiratoires sont informés des conditions métaboliques de l’organisme.Système régulateurLes centres respiratoires sont informés des conditions métaboliques de l’organisme, d’une part, grâce à des chémorécepteurs sensibles à la composition chimique du sang (ces formations situées en aval des poumons, au niveau des gros vaisseaux issus du ventricule gauche, aorte et bifurcation carotidienne, sont reliées aux centres respiratoires par les nerfs de Ludwig-Cyon et de Hering. Cf. HOMÉOSTASIE, fig. 2), d’autre part, grâce à la sensibilité des centres respiratoires vis-à-vis de la composition du sang.Stimulus ventilatoiresOn appelle «stimulus ventilatoire» tout facteur physique ou chimique susceptible de modifier la ventilation en vue de la régler.Stimulus oxygèneLe stimulus oxygène est la pression partielle d’oxygène du sang artériel (p O2) qui est normalement de 90 mm Hg au niveau de la mer. Toute diminution de p O2 (hypoxie) entraîne une augmentation de la ventilation qui tend à ramener p O2 à une valeur plus élevée. Ce stimulus, qui agit uniquement sur un chémorécepteur artériel, intervient surtout lors d’un séjour à haute altitude, ou lorsqu’une hypoxie survient pour des raisons pathologiques.Stimulus gaz carboniqueLe stimulus gaz carbonique est la pression partielle de gaz carbonique du sang artériel (p CO2). Toute élévation de p CO2 (hypercapnie) active les chémorécepteurs artériels et centraux et entraîne une augmentation de l’activité des centres respiratoires. Il en résulte une hyperventilation qui accélère le rejet de gaz carbonique dont la pression tend à revenir à sa valeur initiale. C’est un exemple typique de régulation par rétrocontrôle, ou feedback négatif . Le stimulus gaz carbonique intervient surtout pour régler finement la ventilation de repos. En effet, p CO2, qui est de 38 mm Hg lors de la respiration spontanée, peut augmenter de 10 mm Hg à la fin d’une phrase un peu longue ou diminuer d’autant après un soupir. Ces variations de p CO2 sont rapidement corrigées par des variations de la ventilation.Stimulus pHToute injection d’acide à un animal ou toute production d’acides dans des conditions pathologiques (acidose) telles que coma diabétique, insuffisance rénale, entraîne une hyperventilation. Inversement, un excès de base, ou alcalose, déclenche une hypoventilation. Les chémorécepteurs artériels et centraux sont responsables de ces variations. Le résultat de cette action se comprend mieux lorsque l’on sait que p CO2 et pH sont liés par l’équation de Henderson-Hasselbalch:
Dans les conditions de repos, le volume courant représente une petite fraction du volume de gaz contenu dans les poumons. Pour étudier l’ensemble des volumes pulmonaires, il faut connecter les voies aériennes d’un sujet à un spirographe où les inspirations s’inscrivent vers le haut et les expirations vers le bas (fig. 1). Lorsque le sujet respire calmement, on enregistre aussi une série de volumes courants de repos. Si on demande au sujet d’effectuer une inspiration forcée, un volume, dépassant le volume courant, s’enregistre: c’est le volume de réserve inspiratoire (Vri ). Si on demande une expiration maximale, on enregistre de manière analogue un volume de réserve expiratoire (Vre ). Lorsque les besoins ventilatoires augmentent, le volume courant s’accroît aux dépens des volumes de réserve expiratoire et surtout inspiratoire. Au terme d’une expiration maximale, un certain volume de gaz impossible à expirer reste dans les poumons: c’est le volume résiduel (Vr ). Pour le mesurer, il faut avoir recours à un procédé indirect. On introduit dans le spiromètre un volume v d’hélium pur, gaz inerte non toxique et peu diffusible à l’intérieur de l’organisme. Après une dizaine de minutes, la concentration d’hélium est la même dans le spiromètre et dans les poumons; on détermine la concentration c d’hélium dans le circuit. Par définition, c = v /V, où V est la somme des volumes pulmonaires concernés et du volume du spiromètre qui est connu. Les volumes pulmonaires où l’hélium a diffusé sont le volume résiduel et le volume de réserve expiratoire qu’il est aisé de mesurer directement. Le volume résiduel est ainsi déterminé.Les différents volumes pulmonaires peuvent être groupés entre eux pour réaliser ce qu’on appelle des «capacités». La somme du volume courant et de la réserve inspiratoire représente la capacité inspiratoire (Ci ). La somme de cette dernière avec le volume de réserve expiratoire représente la capacité vitale (Cv): c’est le volume maximal de gaz qui peut être mobilisé entre une inspiration forcée et une expiration forcée. La somme du volume résiduel et du volume de réserve expiratoire représente la capacité résiduelle fonctionnelle (Crf ). À ce niveau, le gaz alvéolaire est en équilibre avec les gaz du sang des capillaires pulmonaires. À chaque cycle ventilatoire, une fraction du volume courant, le volume alvéolaire (Va ), renouvelle la composition des gaz de la capacité résiduelle fonctionnelle. Enfin, la somme de tous les volumes pulmonaires représente la capacité pulmonaire totale (Cpt ). Ces différents volumes et capacités varient d’un individu à l’autre. Des tables donnent les valeurs moyennes de la capacité vitale et du volume résiduel en fonction de la taille du sujet. À taille égale, les volumes pulmonaires de la femme représentent 85 p. 100 de ceux de l’homme. Pour un sujet de taille donnée, les capacités vitale et pulmonaire totale diminuent avec l’âge, alors que le volume résiduel augmente.Mécanique ventilatoireLes déformations de la cage thoracique imposées par les muscles respiratoires rendent possibles l’inspiration et l’expiration des gaz respiratoires.Élasticité thoraciqueLe thorax est une cavité déformable, schématiquement divisible en deux formations élastiques [cf. THORAX]. La paroi externe est formée des os, des muscles, de la peau, etc. Sa face interne est tapissée par le feuillet pariétal de la plèvre. À l’intérieur, les poumons sont tapissés à leur partie superficielle du feuillet viscéral de la plèvre. De fait, les deux feuillets pleuraux sont accolés et représentent l’«espace» pleural, qui est une cavité virtuelle. Si on introduit dans cette cavité une aiguille reliée à un manomètre, on constate qu’au repos la pression intrapleurale est inférieure à la pression atmosphérique. Cette dépression augmente lors de l’inspiration et diminue lors de l’expiration. Si on laisse l’aiguille en communication avec l’atmosphère, de l’air entre dans la cavité pleurale, qui cesse d’être virtuelle: la paroi délimite un volume plus grand, tandis que les poumons se replient sur eux-mêmes, leur volume devenant inférieur au volume résiduel. Cela montre que, chez l’homme intact, il existe entre paroi et poumon des tensions qui s’exercent dans des directions opposées expliquant la dépression pleurale. Toute augmentation du volume pariétal entraîne une augmentation du volume pulmonaire, ce qui crée une différence de pression entre le gaz alvéolaire et l’extérieur, d’où l’inspiration. L’expiration s’explique de manière analogue.Mécanisme d’augmentation du volume thoraciqueMuscles de l’inspiration . Le thorax est fermé à sa partie inférieure par le diaphragme, muscle fixé sur la colonne vertébrale et sur la face interne des côtes inférieures. Il a une forme convexe vers le haut et repose sur les viscères abdominaux. Sa contraction diminue sa longueur et réduit sa convexité; il en résulte une augmentation de hauteur de la cavité thoracique.La contraction des muscles intercostaux externes , qui s’insérent près de la vertèbre sur la côte supérieure et à distance d’elle sur la côte inférieure, élève l’ensemble des côtes, chacune prenant appui sur la côte sus-jacente. Les côtes étant, lorsqu’on les regarde de face, obliques en bas et en dehors, leur élévation entraîne une augmentation de la largeur du thorax. En outre, vues de profil, les côtes sont obliques en bas et en avant; de ce fait, leur élévation lors de l’inspiration projette le sternum en avant et augmente le diamètre antéro-postérieur du thorax. Ainsi, la contraction des muscles inspiratoires accroît-elle les trois dimensions du thorax, donc son volume. Il en résulte une déformation de la formation élastique sous-jacente des poumons, ce qui crée une dépression dans l’espace alvéolaire et entraîne l’entrée d’air ambiant, donc l’inspiration.Muscles de l’expiration . L’expiration est à l’ordinaire passive: l’arrêt de l’action des muscles inspiratoires permet à l’ensemble élastique thoraco-pulmonaire de reprendre sa position d’équilibre qui correspond au volume pulmonaire de fin d’expiration. Cependant, pour une ventilation importante ou pathologique, l’expiration devient active par la mise en jeu des muscles expirateurs, essentiellement les muscles abdominaux dont la contraction refoule les viscères et le diaphragme vers le haut, réduisant le volume thoraco-pulmonaire.Les échanges gazeuxÉchanges gazeux entre l’atmosphère et l’espace alvéolaireEntre les alvéoles et l’extérieur se trouvent interposées les voies aériennes (bouche, trachée, bronches, bronchioles), qui ne participent pas aux échanges respiratoires et sont appelées de ce fait espace mort anatomique . En effet, en fin d’expiration, ce volume se trouve rempli de gaz alvéolaire; lors de l’inspiration suivante, le sujet inspire d’abord le gaz qui a déjà participé aux échanges, puis l’air pur. De même, au début de l’expiration, l’espace mort contient de l’air ambiant; celui-ci est expulsé avant le gaz alvéolaire. Aux deux phases du cycle ventilatoire, l’espace mort diminue en quelque sorte l’efficacité de la ventilation pulmonaire. Le volume expiré (Ve ) est donc la somme du volume de l’espace mort (Vd ) [avec d pour dead , «mort» en anglais] et du volume alvéolaire (Va ). Seul celui-ci participe aux échanges gazeux. Chez un sujet sain, la composition des gaz respiratoires, qui figure au tableau 1 montre que le gaz expiré est du gaz alvéolaire dilué dans l’air ambiant de l’espace mort. En fait, même chez les sujets sains, un certain nombre d’alvéoles ne participent pas aux échanges respiratoires, parce qu’ils ne sont pas perfusés de sang; leur volume, ajouté à celui des voies aériennes, représente l’espace mort physiologique (150 ml env.).Échanges gazeux alvéolo-capillairesLes alvéoles pulmonaires sont séparés des capillaires pulmonaires par une seule couche de cellules endothéliales, la membrane alvéol-capillaire, dont l’épaisseur est de 1 猪m. La surface d’échanges dépasse 50 mètres carrés. Le passage de l’oxygène vers le sang et du gaz carbonique vers l’alvéole se fait par un mécanisme physique de diffusion des régions de haute pression partielle vers les régions de basse pression.Transport des gaz par le sangLes molécules d’oxygène se dissolvent dans les liquides plasmatique et globulaire du sang. La quantité dissoute est très faible (0,3 ml pour 100 ml de sang) et insuffisante pour assurer les besoins de l’organisme. La plus grande partie de l’oxygène se combine chimiquement à un pigment, l’hémoglobine: 1 gramme d’hémoglobine peut fixer 1,34 ml d’oxygène pur en donnant de l’oxyhémoglobine. Un sang normal, contenant 14 p. 100 d’hémoglobine, se charge donc de 14 憐 1,34 = 18,8 ml d’oxygène. Cette quantité appelée pouvoir oxyphorique du sang, ou capacité totale, est, toutes choses étant égales par ailleurs, fonction de la pression partielle d’oxygène dans le plasma (fig. 2). Pour une pression d’oxygène de 100 mm Hg, le contenu en oxygène sera de 17,9 ml p. 100. La saturation du sang en oxygène est donc égale à (17,9/18,8) 憐 100 = 95 p. 100, valeur habituelle chez le sujet sain. Au niveau des tissus, les pressions d’oxygène étant faibles, l’oxyhémoglobine se dissocie en libérant l’oxygène qui parviendra aux cellules par diffusion.Le gaz carbonique produit au niveau des tissus pénètre par diffusion dans le plasma et les globules. Dans les globules, une enzyme - l’anhydrase carbonique - accélère la formation de bicarbonates en présence d’eau (cf. équilibre ACIDO-BASIQUE). Une partie des bicarbonates formés diffuse vers le plasma. Une fraction du gaz carbonique se combine chimiquement à l’hémoglobine. Le contenu du sang en gaz carbonique est fonction de la pression partielle de ce gaz dans le plasma.De fait, le transport de l’oxygène et du gaz carbonique est facilité réciproquement. Le sang transporte d’autant moins d’oxygène que la pression de gaz carbonique est élevée, ce qui facilite la libération d’oxygène au niveau des tissus (effet Bohr). Par ailleurs, le sang fixe d’autant plus de gaz carbonique que la pression d’oxygène est faible (effet Haldane), ce qui facilite la fixation du gaz carbonique au niveau tissulaire.Échanges gazeux entre le sang et les tissusIl a été établi que c’est au niveau des mitochondries qu’ont lieu les oxydations cellulaires [cf. MÉTABOLISME]. Au voisinage des cellules, la pression partielle de l’oxygène n’est que de quelques mm Hg. Bien que très faible, cette pression est suffisante pour alimenter les réactions biochimiques. De ce fait, par un simple mécanisme de diffusion lié à la différence de pression partielle, l’oxygène traverse la membrane alvéolo-capillaire, le liquide interstitiel, la membrane cellulaire et atteint le cytoplasme. La consommation importante d’oxygène par les mitochondries, d’une part, et la distance relativement grande (à l’echelle cellulaire) entre les capillaires et les mitochondries, d’autre part, expliquent la différence de pression partielle du sang (100 mm Hg) et des mitochondries (quelques mm Hg). Le passage de l’oxygène du sang à travers les capillaires entraîne une baisse de la pression partielle d’oxygène dans le sang et une dissociation de l’oxyhémoglobine (fig. 2).Le gaz carbonique, produit par les oxydations cellulaires, migre, selon un cheminement inverse, des mitochondries vers les capillaires sanguins, par de simples mécanismes de diffusion dus aux différences de pression partielle.La régulation de la respirationNécessité d’une régulationDans la région bulbo-protubérentielle du tronc cérébral, des formations nerveuses, les centres respiratoires , sont à l’origine des influx nerveux responsables de la contraction plus ou moins intense des muscles inspiratoires et expiratoires et, en définitive, de l’intensité de la respiration. Celle-ci doit être adaptée aux besoins de l’organisme: un homme au repos consomme 0,2 litre min-1; au cours d’un exercice musculaire intense, la consommation peut atteindre 4 litres min-1, soit vingt fois plus qu’au repos, ce qui nécessite une adaptation respiratoire et circulatoire. Cela n’est possible que si les centres respiratoires sont informés des conditions métaboliques de l’organisme.Système régulateurLes centres respiratoires sont informés des conditions métaboliques de l’organisme, d’une part, grâce à des chémorécepteurs sensibles à la composition chimique du sang (ces formations situées en aval des poumons, au niveau des gros vaisseaux issus du ventricule gauche, aorte et bifurcation carotidienne, sont reliées aux centres respiratoires par les nerfs de Ludwig-Cyon et de Hering. Cf. HOMÉOSTASIE, fig. 2), d’autre part, grâce à la sensibilité des centres respiratoires vis-à-vis de la composition du sang.Stimulus ventilatoiresOn appelle «stimulus ventilatoire» tout facteur physique ou chimique susceptible de modifier la ventilation en vue de la régler.Stimulus oxygèneLe stimulus oxygène est la pression partielle d’oxygène du sang artériel (p O2) qui est normalement de 90 mm Hg au niveau de la mer. Toute diminution de p O2 (hypoxie) entraîne une augmentation de la ventilation qui tend à ramener p O2 à une valeur plus élevée. Ce stimulus, qui agit uniquement sur un chémorécepteur artériel, intervient surtout lors d’un séjour à haute altitude, ou lorsqu’une hypoxie survient pour des raisons pathologiques.Stimulus gaz carboniqueLe stimulus gaz carbonique est la pression partielle de gaz carbonique du sang artériel (p CO2). Toute élévation de p CO2 (hypercapnie) active les chémorécepteurs artériels et centraux et entraîne une augmentation de l’activité des centres respiratoires. Il en résulte une hyperventilation qui accélère le rejet de gaz carbonique dont la pression tend à revenir à sa valeur initiale. C’est un exemple typique de régulation par rétrocontrôle, ou feedback négatif . Le stimulus gaz carbonique intervient surtout pour régler finement la ventilation de repos. En effet, p CO2, qui est de 38 mm Hg lors de la respiration spontanée, peut augmenter de 10 mm Hg à la fin d’une phrase un peu longue ou diminuer d’autant après un soupir. Ces variations de p CO2 sont rapidement corrigées par des variations de la ventilation.Stimulus pHToute injection d’acide à un animal ou toute production d’acides dans des conditions pathologiques (acidose) telles que coma diabétique, insuffisance rénale, entraîne une hyperventilation. Inversement, un excès de base, ou alcalose, déclenche une hypoventilation. Les chémorécepteurs artériels et centraux sont responsables de ces variations. Le résultat de cette action se comprend mieux lorsque l’on sait que p CO2 et pH sont liés par l’équation de Henderson-Hasselbalch: où pK et a sont des constantes. L’injection d’acide décompose les bicarbonates (HCO3-). L’hyperventilation observée diminue p CO2, ce qui ramène le pH à sa valeur normale (7,40). Dans ce cas, la ventilation est au service de l’équilibre acido-basique. En revanche, lorsqu’une augmentation du métabolisme provoque une élévation de p CO2, il en résulte une perturbation de l’équilibre acido-basique, c’est-à-dire une acidose; celle-ci, jointe à l’action de l’hypercapnie, accélère le rejet de gaz carbonique par hyperventilation, ce qui tend à ramener rapidement le pH à sa valeur initiale.Stimulus nerveuxIl est possible d’arrêter volontairement de respirer durant quelques minutes. De même, lors d’activités telles que la parole, la déglutition, la défécation, le fonctionnement régulier de la ventilation se trouve transitoirement altéré. Cela est expliqué par les relations nerveuses qui existent entre les centres respiratoires et les centres responsables d’autres fonctions biologiques.Au début d’un exercice musculaire, ou simplement lorsque les jambes pendantes d’un sujet couché sont mobilisées passivement, on observe une augmentation immédiate de la ventilation. Ce stimulus neurogénique de l’exercice musculaire a pour origine des formations sensibles aux mouvements situées à l’intérieur des muscles. Ainsi le mouvement lui-même est-il à l’origine d’une partie de l’hyperventilation observée pendant l’exercice. Ce stimulus, agissant très rapidement, évite à l’organisme de contracter une dette d’oxygène excessive; en effet, le délai entre le début d’un exercice et le moment où le sang altéré issu des muscles parvient aux chémorécepteurs est de quelques dizaines de secondes.La mise en jeu de la ventilation règle donc la respiration, c’est-à-dire qu’elle maintient constante la composition du milieu intérieur.Régulation mécanique de la ventilationAussitôt que des sécrétions, par exemple, obstruent en partie les voies aériennes, les centres respiratoires font développer aux muscles respiratoires un certain travail. La présence d’une résistance supplémentaire ne permettra pas d’inspirer un volume d’air suffisant. D’où la nécessité pour les centres respiratoires d’être informés des conditions mécaniques qui existent dans le thorax. Cette information naît à partir de mécanorécepteurs pulmonaires , sensibles à la distension des poumons. L’activité des nerfs qui en sont issus est proportionnelle au volume pulmonaire et contribue ainsi à informer les centres respiratoires de l’état de distension des poumons. Ces nerfs gagnent les centres en empruntant le trajet des nerfs pneumogastriques. C’est un autre exemple de régulation de l’activité des centres respiratoires par rétrocontrôle.Ainsi se trouvent réunies dans les centres respiratoires des informations mécaniques d’origine thoracique, des informations humorales venues des chémorécepteurs, des informations nerveuses d’origine centrale ou d’origine périphérique. Les centres respiratoires ont une activité rythmique propre réglée selon la nature et l’intensité des différentes informations reçues. La ventilation pulmonaire s’adapte donc à la régulation de la respiration et au maintien de l’homéostasie.2. ApplicationsLa respiration artificielleLa respiration artificielle désigne habituellement les méthodes mises en œuvre pour réaliser ce qu’il serait plus exact d’appeler une «ventilation pulmonaire assistée». Elle nécessite non seulement une ventilation, mais aussi une circulation artificielle, si cette dernière est interrompue, afin de permettre une respiration tissulaire normale. Il existe aussi des appareils pour assurer la respiration du sang au cours d’interventions nécessitant une circulation extra-corporelle, mais on se limitera ici à l’étude de la respiration pulmonaire artificielle.Autrefois, la respiration artificielle était entreprise pendant quelques minutes ou quelques heures en attendant la reprise de la ventilation spontanée. Elle est actuellement poursuivie parfois pendant des mois ou des années, voire toute la vie lors d’une perte définitive de la fonction ventilatoire dans certaines affections telles que la poliomyélite, la myasthénie et les traumatismes cervicaux. Cette évolution a entraîné celle des techniques, et un grand nombre de méthodes plus ou moins efficaces ont été conçues. Seules seront exposées les méthodes les plus utilisées de nos jours en raison de leur efficacité. On peut classer ces méthodes en deux catégories: celles qui peuvent être mises en œuvre par n’importe qui, sans l’aide d’instrument, sur les lieux mêmes de l’accident, en attendant l’arrivée d’une équipe spécialisée, et celles dont disposent les services de réanimation.Respiration pulmonaire artificielle sans l’aide d’instrumentLors d’une syncope respiratoire, la respiration artificielle doit être entreprise le plus rapidement possible, car on ne dispose que de quelques minutes avant que l’hypoxie ne provoque des lésions définitives. Cependant, un certain nombre de précautions doivent être prises avant de commencer les manœuvres de respiration assistée; il faut:– s’assurer, par auscultation thoracique dans la région précordiale, qu’il n’y a pas arrêt cardiaque; si tel est le cas, on mettra immédiatement en œuvre une réanimation circulatoire par la méthode de Kouwenhoven (massage cardiaque à thorax fermé);– s’assurer que les voies aériennes ne sont pas encombrées par des corps étrangers ou des sécrétions dont la présence rendrait toute ventilation inefficace; il est souvent possible de les dégager en passant l’index le plus loin possible derrière la langue.La méthode la plus utilisée actuellement est celle du bouche-à-bouche; d’abord utilisée pour la réanimation des nouveau-nés, cette technique est de plus en plus employée chez l’adulte. Elle nécessite d’abord le dégagement des voies aériennes supérieures en portant la tête en arrière et en luxant en avant la mâchoire inférieure. Puis, le réanimateur inspire de l’air ambiant et l’expire dans la bouche ouverte du malade dont le nez est pincé. Il n’est pas nécessaire de souffler très fort pour gonfler le thorax. Lorsque le réanimateur se relève, le thorax revient à sa position de relaxation par une expiration passive. Cette manœuvre, répétée vingt fois par minute chez un adulte, soixante fois par minute chez un nouveau-né, est poursuivie jusqu’à l’arrivée d’une équipe spécialisée ou la reprise d’une ventilation spontanée. Le soulèvement du thorax lors de l’insufflation permet de vérifier la bonne marche de l’opération. Si les voies aériennes du sujet n’étaient pas dégagées, on assisterait au gonflement de l’estomac par la voie de l’œsophage.Respiration pulmonaire artificielle avec l’aide d’appareilsLes méthodes internes et externes ont des indications respectives, dont la discussion dépasse le cadre de cet exposé.Méthodes internesToutes les méthodes internes ont en commun d’insuffler un gaz au travers d’un masque, ou d’une canule d’intubation trachéale, ou d’une canule de trachéotomie. Ces deux dernières méthodes présentent l’avantage de permettre l’aspiration de mucosités bronchiques à l’aide d’une pompe d’aspiration et d’une sonde.Un ballon de caoutchouc est relié d’une part à une bouteille d’oxygène sous pression, d’autre part à la canule au travers d’un jeu de soupapes. L’opérateur appuie rythmiquement sur le ballon légèrement gonflé; la surpression réalise l’inspiration, l’expiration est passive.On peut aussi utiliser des pompes électriques appelées «respirateurs» (type Engström). La canule est reliée à la pompe qui crée une insufflation par surpression et une exsufflation active par une légère dépression. Ces appareils permettent de réaliser: d’une part, un débit ventilatoire donné à une fréquence déterminée, sans risque de surpression excessive (il est possible, de plus, de régler les durées respectives de l’inspiration et de l’expiration et d’enrichir plus ou moins le gaz inspiré en oxygène); d’autre part, des ventilations assistées à long terme, mais il faut procéder à un contrôle régulier des valeurs de pH, p CO2 et p O2 du sang artériel pour guider les réglages de la pompe.À noter que l’inspiration est obtenue par une surpression alvéolaire, alors que, physiologiquement, c’est une dépression qui réalise l’inspiration. Cela a pour conséquence, entre autres, de créer des perturbations hémodynamiques dont il devra être tenu compte dans la réanimation.Méthodes externesMéthode du caisson , dit poumon d’acier . Le corps du sujet est enfermé dans un caisson rigide. Seule la tête dépasse, un manchon assure l’étanchéité. Une pompe crée autour du corps du malade des dépressions et des surpressions qui mobilisent le thorax.Méthode du lit basculant . Le malade est couché sur une table basculante de manière que son diaphragme soit au niveau de l’axe de rotation. Le poids des viscères entraîne le diaphragme alternativement vers le bas et vers le haut reproduisant les mouvements spontanés.La physiologie de la plongéeOn traitera essentiellement des problèmes physiologiques posés par la plongée, et d’une manière plus générale des problèmes que pose l’inhalation d’un mélange respiratoire à des pressions supérieures à la normale. La plongée sans appareils, ou plongée en apnée, présente peu d’intérêt; en effet, à cause de la faiblesse de ses réserves d’air, l’homme ne peut séjourner sous l’eau plus de quelques minutes et ne peut guère dépasser une profondeur de vingt mètres environ. Toutefois, certains Mammifères marins peuvent plonger à plusieurs centaines de mètres pendant une heure et plus.Troubles liés à la pression des gazEffets de la pressionChaque fois que l’on s’enfonce de 10 mètres sous la surface de la mer, la pression augmente de 1 bar. Ainsi, un homme plongeant à 50 mètres est soumis à une pression totale de 6 bars. Cette pression ambiante doit être équilibrée en permanence par la pression régnant à l’intérieur de l’organisme. Cette condition interdit la plongée aux personnes atteintes de certaines affections auriculaires pour lesquelles il n’est pas possible d’équilibrer la pression de la caisse du tympan avec la pression ambiante.Effets de l’augmentation de la pression d’oxygèneLa pression partielle d’oxygène de l’air au niveau de la mer est de 0,2 bar; à une profondeur de 50 mètres, elle est de: 0,2 憐 6 = 1,2 bar. Contrairement à ce que l’on croit, l’oxygène inhalé à haute pression est toxique. L’inhalation, pendant vingt-quatre heures, d’oxygène sous une pression partielle supérieure à 0,6 bar entraîne des lésions de congestion et d’œdème pulmonaires. Pour des pressions plus élevées, les troubles apparaissent plus rapidement. Pour des pressions supérieures à 1,7 bar, le risque devient imminent, ce qui limite la plongée avec de l’air à 1,7/0,2 = 8,5 bars, correspondant à une profondeur de 75 mètres.Effets de l’augmentation de la pression d’azoteLa pression d’azote au niveau de la mer est de 0,8 bar. En plongée, des troubles connus sous le nom d’ivresse des profondeurs apparaissent lorsque la pression d’azote dépasse 4 bars, soit 4/0,8 = 5 bars de pression totale, ce qui correspond à 40 mètres. L’inhalation prolongée d’azote à une pression partielle supérieure entraîne un coma, ou narcose à l’azote. De ce fait, il n’est guère possible de plonger en respirant longtemps de l’air à des profondeurs supérieures à 50 mètres.Plongées profondesPour pallier ces actions toxiques des gaz naturels à forte pression, on leur substitue d’autres gaz inertes: l’hélium en particulier. La teneur en oxygène du mélange est calculée de telle manière que, à la profondeur atteinte, la pression d’oxygène ne dépasse pas 0,5 bar. C’est ainsi que l’homme peut plonger en mer à une profondeur de 100 mètres, en respirant un mélange de 5 p. 100 d’oxygène et de 95 p. 100 d’hélium. Expérimentalement, en caisson, il a été réalisé des plongées fictives d’animaux jusqu’à 1 200 mètres avec un tel mélange, en maintenant la pression partielle d’oxygène à environ 0,5 bar.Troubles liés aux changements rapides de pressionGaz en solution dans l’organismeLa quantité de gaz dissous dans l’organisme est proportionnelle à la pression de ce gaz. Il faut cependant remarquer que ce phénomène n’est pas instantané; en effet, dans les poumons, les gaz s’équilibrent d’abord avec le sang. Celui-ci véhicule ces gaz dans les différents territoires. Ceux qui sont peu irrigués ne seront saturés qu’après plusieurs heures: pour des plongées brèves, la quantité dissoute est loin de la saturation. Pour la même raison, l’évacuation des gaz lors de la remontée est très lente. L’oxygène pose moins de problèmes, car il est consommé au niveau des tissus. En revanche, la dénitrogénation est à l’origine des accidents observés lors de la remontée et après la remontée. Lorsqu’on décomprime un gaz en équilibre avec un liquide, il y a formation de bulles gazeuses: la remontée devrait donc provoquer l’apparition de bulles de grosseur croissante dans les tissus et dans le sang. En réalité, ce phénomène n’est observé que pour des différences de pression importantes, c’est-à-dire pour des remontées rapides. Lorsque la variation de pression est lente, les bulles ne se forment pas, le gaz reste en sursaturation; toutefois elles peuvent apparaître, à l’occasion d’un choc en particulier.Accidents de décompressionLes accidents de décompression surviennent dans les minutes ou les heures qui suivent la remontée. L’apparition des bulles dans les tissus peut provoquer des lésions plus ou moins graves. Les troubles sont précédés de douleurs articulaires et rétrosternales, de picotements. Les accidents les plus graves sont des atteintes du système nerveux central, caractérisées par l’apparition de surdité, de cécité, de paralysies plus ou moins étendues. Le traitement consiste en une recompression immédiate dans une chambre suffisamment vaste pour qu’un médecin puisse accompagner le malade. Cette recompression diminue le volume des bulles, mais leur redissolution est lente pour les raisons évoquées précédemment. La régression des troubles est fréquente.La prévention de ces accidents est réalisée en procédant à une remontée par paliers tels que les gaz restent en sursaturation. Des tables fixent la profondeur et la durée de la plongée. Lors de plongées rapprochées, il est tenu compte de la dénitrogénation incomplète. Enfin, il existe toujours sur les lieux de plongée professionnelle des caissons où il est possible de recomprimer rapidement le plongeur en cas d’accident. Pour toutes ces raisons, il est déconseillé de plonger seul, sans être instruit des principes élémentaires nécessaires à la plongée, et loin d’un centre médical équipé.3. PhysiopathologieL’exploration fonctionnelle respiratoire permet de mieux saisir les grands désordres physiopathologiques abordés plus loin. Elle apporte une aide diagnostique et thérapeutique aux pneumologues.L’exploration fonctionnelle respiratoireSpirométrieLe sujet étant relié à un spiromètre, on mesure les différents volumes et capacités pulmonaires (cf. Volumes pulmonaires , in chap. 1). Les résultats sont exprimés en pourcentage de la normale, à l’aide de tables tenant compte de la taille, de l’âge et du sexe du sujet. De plus, le technicien demande au sujet d’effectuer une inspiration forcée, et, tout en augmentant la vitesse de rotation du spiromètre, il l’incite à expirer le plus rapidement possible. Cela permet de mesurer le volume maximal expiré en une seconde , ou Vems (fig. 3a). Normalement, un sujet expire ainsi 75 p. 100 de sa capacité vitale (Cv). Le rapport Vems /Cv est appelé rapport de Tiffeneau .Mesure du transfert de l’oxyde de carboneLe but de cet examen est d’apprécier l’aptitude de la membrane alvéolo-capillaire à laisser passer les molécules d’oxygène dans le sang. Pour ce faire, il faudrait mesurer le nombre de millilitres d’oxygène qui traversent la membrane lorsqu’il existe une différence de pression d’oxygène de 1 torr entre le gaz alvéolaire et le sang capillaire. Malheureusement, il est impossible de prélever ce sang. On tourne la difficulté en faisant inhaler au sujet un mélange gazeux contenant une faible quantité d’oxyde de carbone (CO), gaz ayant une très forte affinité pour l’hémoglobine. On peut admettre que la pression dans le sang capillaire est nulle. Il suffit alors de mesurer la quantité d’oxyde de carbone prélevée par minute et la pression alvéolaire de ce gaz, puis de faire le rapport de ces deux valeurs. On obtient ainsi le coefficient de transfert de l’oxyde de carbone, qui est normalement de 15 ml.min-1.(mm Hg)-1. La diffusion alvéolo-capillaire étant un phénomène physique passif, le transfert de l’oxygène est proportionnel au transfert de l’oxyde de carbone.Gaz du sangEn physiopathologie respiratoire, seule est intéressante l’étude des gaz du sang des artères de la grande circulation, puisqu’elles sont situées en aval des capillaires pulmonaires. La ponction artérielle est aisée et pratiquement indolore. Sur ce sang, on mesure actuellement les pressions partielles d’oxygène et de gaz carbonique, ainsi que le pH, à l’aide d’électrodes étalonnées avec des solutions de composition connue. Des abaques permettent de calculer, à partir de ces données, la saturation du sang en oxyhémoglobine et la concentration du plasma en bicarbonates, ou réserve alcaline. L’ensemble de ces données renseigne, d’une part, sur la valeur des échanges gazeux par les pressions d’oxygène et de gaz carbonique; d’autre part, sur l’équilibre acido-basique de l’organisme, qui peut être perturbé dans les insuffisances respiratoires, mais aussi dans certaines affections métaboliques ou rénales.Les grands syndromes physiopathologiques respiratoiresSyndrome restrictifLa destruction d’une partie du parenchyme pulmonaire entraîne un syndrome restrictif. La spirométrie apprécie son importance par la valeur du rapport capacité vitale sur capacité vitale théorique (fig. 3b). La diminution de la capacité vitale peut être le fait soit d’une diminution de la capacité pulmonaire totale, comme cela se voit lors de l’ablation de tout ou partie d’un poumon, soit d’une redistribution des volumes pulmonaires, comme dans l’emphysème où le volume résiduel augmente aux dépens de la capacité vitale.Syndrome obstructifIl y a syndrome obstructif chaque fois qu’il existe une gêne à l’écoulement des gaz dans les voies aériennes. L’obstacle, qui peut sièger à différents niveaux (œdème des laryngites, corps étranger trachéobronchique fréquent chez l’enfant, cancer bronchique), entraîne une difficulté à respirer, ou dyspnée, parfois dramatique. Le syndrome obstructif de loin le plus fréquent est celui de l’asthme et surtout de la bronchite chronique.Pendant les crises d’asthme , une constriction des muscles des bronches réduit le diamètre de ces dernières. Cela est accentué pendant l’expiration qui devient longue et difficile. Le syndrome obstructif n’existe pas nécessairement dans l’intervalle des crises.La bronchite chronique est, en général, le fait de la persistance d’une infection des voies respiratoires favorisée par la pollution aérienne et le tabagisme. Les parois des bronches et des bronchioles sont le siège permanent d’un œdème qui en réduit la lumière. Il faudra déployer des pressions importantes pour mobiliser les gaz. Ces surpressions peuvent faciliter l’apparition de l’emphysème qui, schématiquement, représente la destruction des parois des alvéoles, qui se trouvent alors réunies en grands sacs où les échanges gazeux ne se font que peu ou mal.L’exploration fonctionnelle respiratoire des syndromes obstructifs est caractérisée par une diminution du rapport de Tiffeneau (fig. 3 c). Le risque de décompensation respiratoire est grand lorsque le Vems devient inférieur à 11.s-1; cela correspond pour le malade à l’impossibilité d’évacuer correctement ses sécrétions bronchiques. Dans la bronchite chronique avec emphysème, on observe l’apparition secondaire d’un syndrome restrictif avec augmentation du volume résiduel. À ce stade apparaît souvent une hypoventilation alvéolaire avec hypoxie et hypercapnie, qui vont en s’aggravant à chaque poussée de la maladie.Trouble du transfert de l’oxygèneLa qualité de la membrane alvéolo-capillaire peut se trouver altérée dans certaines affections, ou fibroses, dues à des maladies professionnelles, des cancers pulmonaires ou des maladies de nature inconnue. La caractéristique fonctionnelle de ces affections est l’apparition d’une hypoxie avec hypocapnie et d’une diminution du coefficient de transfert de l’oxyde de carbone. L’hypocapnie, qui accompagne l’hypoxie, s’explique par le fait que le gaz carbonique est vingt fois plus diffusible que l’oxygène. Il y a, dans un premier temps, une baisse de la pression partielle d’oxygène, ou hypoxie (cf. supra , chap.1), qui entraîne une hyperventilation. Celle-ci est suffisante pour augmenter le rejet du gaz carbonique et provoquer l’hypocapnie, mais ne l’est pas pour rétablir une valeur de pression partielle d’oxygène normale. Ce trouble de diffusion accompagne souvent, à des degrés divers, certaines bronchopneumopathies.
où pK et a sont des constantes. L’injection d’acide décompose les bicarbonates (HCO3-). L’hyperventilation observée diminue p CO2, ce qui ramène le pH à sa valeur normale (7,40). Dans ce cas, la ventilation est au service de l’équilibre acido-basique. En revanche, lorsqu’une augmentation du métabolisme provoque une élévation de p CO2, il en résulte une perturbation de l’équilibre acido-basique, c’est-à-dire une acidose; celle-ci, jointe à l’action de l’hypercapnie, accélère le rejet de gaz carbonique par hyperventilation, ce qui tend à ramener rapidement le pH à sa valeur initiale.Stimulus nerveuxIl est possible d’arrêter volontairement de respirer durant quelques minutes. De même, lors d’activités telles que la parole, la déglutition, la défécation, le fonctionnement régulier de la ventilation se trouve transitoirement altéré. Cela est expliqué par les relations nerveuses qui existent entre les centres respiratoires et les centres responsables d’autres fonctions biologiques.Au début d’un exercice musculaire, ou simplement lorsque les jambes pendantes d’un sujet couché sont mobilisées passivement, on observe une augmentation immédiate de la ventilation. Ce stimulus neurogénique de l’exercice musculaire a pour origine des formations sensibles aux mouvements situées à l’intérieur des muscles. Ainsi le mouvement lui-même est-il à l’origine d’une partie de l’hyperventilation observée pendant l’exercice. Ce stimulus, agissant très rapidement, évite à l’organisme de contracter une dette d’oxygène excessive; en effet, le délai entre le début d’un exercice et le moment où le sang altéré issu des muscles parvient aux chémorécepteurs est de quelques dizaines de secondes.La mise en jeu de la ventilation règle donc la respiration, c’est-à-dire qu’elle maintient constante la composition du milieu intérieur.Régulation mécanique de la ventilationAussitôt que des sécrétions, par exemple, obstruent en partie les voies aériennes, les centres respiratoires font développer aux muscles respiratoires un certain travail. La présence d’une résistance supplémentaire ne permettra pas d’inspirer un volume d’air suffisant. D’où la nécessité pour les centres respiratoires d’être informés des conditions mécaniques qui existent dans le thorax. Cette information naît à partir de mécanorécepteurs pulmonaires , sensibles à la distension des poumons. L’activité des nerfs qui en sont issus est proportionnelle au volume pulmonaire et contribue ainsi à informer les centres respiratoires de l’état de distension des poumons. Ces nerfs gagnent les centres en empruntant le trajet des nerfs pneumogastriques. C’est un autre exemple de régulation de l’activité des centres respiratoires par rétrocontrôle.Ainsi se trouvent réunies dans les centres respiratoires des informations mécaniques d’origine thoracique, des informations humorales venues des chémorécepteurs, des informations nerveuses d’origine centrale ou d’origine périphérique. Les centres respiratoires ont une activité rythmique propre réglée selon la nature et l’intensité des différentes informations reçues. La ventilation pulmonaire s’adapte donc à la régulation de la respiration et au maintien de l’homéostasie.2. ApplicationsLa respiration artificielleLa respiration artificielle désigne habituellement les méthodes mises en œuvre pour réaliser ce qu’il serait plus exact d’appeler une «ventilation pulmonaire assistée». Elle nécessite non seulement une ventilation, mais aussi une circulation artificielle, si cette dernière est interrompue, afin de permettre une respiration tissulaire normale. Il existe aussi des appareils pour assurer la respiration du sang au cours d’interventions nécessitant une circulation extra-corporelle, mais on se limitera ici à l’étude de la respiration pulmonaire artificielle.Autrefois, la respiration artificielle était entreprise pendant quelques minutes ou quelques heures en attendant la reprise de la ventilation spontanée. Elle est actuellement poursuivie parfois pendant des mois ou des années, voire toute la vie lors d’une perte définitive de la fonction ventilatoire dans certaines affections telles que la poliomyélite, la myasthénie et les traumatismes cervicaux. Cette évolution a entraîné celle des techniques, et un grand nombre de méthodes plus ou moins efficaces ont été conçues. Seules seront exposées les méthodes les plus utilisées de nos jours en raison de leur efficacité. On peut classer ces méthodes en deux catégories: celles qui peuvent être mises en œuvre par n’importe qui, sans l’aide d’instrument, sur les lieux mêmes de l’accident, en attendant l’arrivée d’une équipe spécialisée, et celles dont disposent les services de réanimation.Respiration pulmonaire artificielle sans l’aide d’instrumentLors d’une syncope respiratoire, la respiration artificielle doit être entreprise le plus rapidement possible, car on ne dispose que de quelques minutes avant que l’hypoxie ne provoque des lésions définitives. Cependant, un certain nombre de précautions doivent être prises avant de commencer les manœuvres de respiration assistée; il faut:– s’assurer, par auscultation thoracique dans la région précordiale, qu’il n’y a pas arrêt cardiaque; si tel est le cas, on mettra immédiatement en œuvre une réanimation circulatoire par la méthode de Kouwenhoven (massage cardiaque à thorax fermé);– s’assurer que les voies aériennes ne sont pas encombrées par des corps étrangers ou des sécrétions dont la présence rendrait toute ventilation inefficace; il est souvent possible de les dégager en passant l’index le plus loin possible derrière la langue.La méthode la plus utilisée actuellement est celle du bouche-à-bouche; d’abord utilisée pour la réanimation des nouveau-nés, cette technique est de plus en plus employée chez l’adulte. Elle nécessite d’abord le dégagement des voies aériennes supérieures en portant la tête en arrière et en luxant en avant la mâchoire inférieure. Puis, le réanimateur inspire de l’air ambiant et l’expire dans la bouche ouverte du malade dont le nez est pincé. Il n’est pas nécessaire de souffler très fort pour gonfler le thorax. Lorsque le réanimateur se relève, le thorax revient à sa position de relaxation par une expiration passive. Cette manœuvre, répétée vingt fois par minute chez un adulte, soixante fois par minute chez un nouveau-né, est poursuivie jusqu’à l’arrivée d’une équipe spécialisée ou la reprise d’une ventilation spontanée. Le soulèvement du thorax lors de l’insufflation permet de vérifier la bonne marche de l’opération. Si les voies aériennes du sujet n’étaient pas dégagées, on assisterait au gonflement de l’estomac par la voie de l’œsophage.Respiration pulmonaire artificielle avec l’aide d’appareilsLes méthodes internes et externes ont des indications respectives, dont la discussion dépasse le cadre de cet exposé.Méthodes internesToutes les méthodes internes ont en commun d’insuffler un gaz au travers d’un masque, ou d’une canule d’intubation trachéale, ou d’une canule de trachéotomie. Ces deux dernières méthodes présentent l’avantage de permettre l’aspiration de mucosités bronchiques à l’aide d’une pompe d’aspiration et d’une sonde.Un ballon de caoutchouc est relié d’une part à une bouteille d’oxygène sous pression, d’autre part à la canule au travers d’un jeu de soupapes. L’opérateur appuie rythmiquement sur le ballon légèrement gonflé; la surpression réalise l’inspiration, l’expiration est passive.On peut aussi utiliser des pompes électriques appelées «respirateurs» (type Engström). La canule est reliée à la pompe qui crée une insufflation par surpression et une exsufflation active par une légère dépression. Ces appareils permettent de réaliser: d’une part, un débit ventilatoire donné à une fréquence déterminée, sans risque de surpression excessive (il est possible, de plus, de régler les durées respectives de l’inspiration et de l’expiration et d’enrichir plus ou moins le gaz inspiré en oxygène); d’autre part, des ventilations assistées à long terme, mais il faut procéder à un contrôle régulier des valeurs de pH, p CO2 et p O2 du sang artériel pour guider les réglages de la pompe.À noter que l’inspiration est obtenue par une surpression alvéolaire, alors que, physiologiquement, c’est une dépression qui réalise l’inspiration. Cela a pour conséquence, entre autres, de créer des perturbations hémodynamiques dont il devra être tenu compte dans la réanimation.Méthodes externesMéthode du caisson , dit poumon d’acier . Le corps du sujet est enfermé dans un caisson rigide. Seule la tête dépasse, un manchon assure l’étanchéité. Une pompe crée autour du corps du malade des dépressions et des surpressions qui mobilisent le thorax.Méthode du lit basculant . Le malade est couché sur une table basculante de manière que son diaphragme soit au niveau de l’axe de rotation. Le poids des viscères entraîne le diaphragme alternativement vers le bas et vers le haut reproduisant les mouvements spontanés.La physiologie de la plongéeOn traitera essentiellement des problèmes physiologiques posés par la plongée, et d’une manière plus générale des problèmes que pose l’inhalation d’un mélange respiratoire à des pressions supérieures à la normale. La plongée sans appareils, ou plongée en apnée, présente peu d’intérêt; en effet, à cause de la faiblesse de ses réserves d’air, l’homme ne peut séjourner sous l’eau plus de quelques minutes et ne peut guère dépasser une profondeur de vingt mètres environ. Toutefois, certains Mammifères marins peuvent plonger à plusieurs centaines de mètres pendant une heure et plus.Troubles liés à la pression des gazEffets de la pressionChaque fois que l’on s’enfonce de 10 mètres sous la surface de la mer, la pression augmente de 1 bar. Ainsi, un homme plongeant à 50 mètres est soumis à une pression totale de 6 bars. Cette pression ambiante doit être équilibrée en permanence par la pression régnant à l’intérieur de l’organisme. Cette condition interdit la plongée aux personnes atteintes de certaines affections auriculaires pour lesquelles il n’est pas possible d’équilibrer la pression de la caisse du tympan avec la pression ambiante.Effets de l’augmentation de la pression d’oxygèneLa pression partielle d’oxygène de l’air au niveau de la mer est de 0,2 bar; à une profondeur de 50 mètres, elle est de: 0,2 憐 6 = 1,2 bar. Contrairement à ce que l’on croit, l’oxygène inhalé à haute pression est toxique. L’inhalation, pendant vingt-quatre heures, d’oxygène sous une pression partielle supérieure à 0,6 bar entraîne des lésions de congestion et d’œdème pulmonaires. Pour des pressions plus élevées, les troubles apparaissent plus rapidement. Pour des pressions supérieures à 1,7 bar, le risque devient imminent, ce qui limite la plongée avec de l’air à 1,7/0,2 = 8,5 bars, correspondant à une profondeur de 75 mètres.Effets de l’augmentation de la pression d’azoteLa pression d’azote au niveau de la mer est de 0,8 bar. En plongée, des troubles connus sous le nom d’ivresse des profondeurs apparaissent lorsque la pression d’azote dépasse 4 bars, soit 4/0,8 = 5 bars de pression totale, ce qui correspond à 40 mètres. L’inhalation prolongée d’azote à une pression partielle supérieure entraîne un coma, ou narcose à l’azote. De ce fait, il n’est guère possible de plonger en respirant longtemps de l’air à des profondeurs supérieures à 50 mètres.Plongées profondesPour pallier ces actions toxiques des gaz naturels à forte pression, on leur substitue d’autres gaz inertes: l’hélium en particulier. La teneur en oxygène du mélange est calculée de telle manière que, à la profondeur atteinte, la pression d’oxygène ne dépasse pas 0,5 bar. C’est ainsi que l’homme peut plonger en mer à une profondeur de 100 mètres, en respirant un mélange de 5 p. 100 d’oxygène et de 95 p. 100 d’hélium. Expérimentalement, en caisson, il a été réalisé des plongées fictives d’animaux jusqu’à 1 200 mètres avec un tel mélange, en maintenant la pression partielle d’oxygène à environ 0,5 bar.Troubles liés aux changements rapides de pressionGaz en solution dans l’organismeLa quantité de gaz dissous dans l’organisme est proportionnelle à la pression de ce gaz. Il faut cependant remarquer que ce phénomène n’est pas instantané; en effet, dans les poumons, les gaz s’équilibrent d’abord avec le sang. Celui-ci véhicule ces gaz dans les différents territoires. Ceux qui sont peu irrigués ne seront saturés qu’après plusieurs heures: pour des plongées brèves, la quantité dissoute est loin de la saturation. Pour la même raison, l’évacuation des gaz lors de la remontée est très lente. L’oxygène pose moins de problèmes, car il est consommé au niveau des tissus. En revanche, la dénitrogénation est à l’origine des accidents observés lors de la remontée et après la remontée. Lorsqu’on décomprime un gaz en équilibre avec un liquide, il y a formation de bulles gazeuses: la remontée devrait donc provoquer l’apparition de bulles de grosseur croissante dans les tissus et dans le sang. En réalité, ce phénomène n’est observé que pour des différences de pression importantes, c’est-à-dire pour des remontées rapides. Lorsque la variation de pression est lente, les bulles ne se forment pas, le gaz reste en sursaturation; toutefois elles peuvent apparaître, à l’occasion d’un choc en particulier.Accidents de décompressionLes accidents de décompression surviennent dans les minutes ou les heures qui suivent la remontée. L’apparition des bulles dans les tissus peut provoquer des lésions plus ou moins graves. Les troubles sont précédés de douleurs articulaires et rétrosternales, de picotements. Les accidents les plus graves sont des atteintes du système nerveux central, caractérisées par l’apparition de surdité, de cécité, de paralysies plus ou moins étendues. Le traitement consiste en une recompression immédiate dans une chambre suffisamment vaste pour qu’un médecin puisse accompagner le malade. Cette recompression diminue le volume des bulles, mais leur redissolution est lente pour les raisons évoquées précédemment. La régression des troubles est fréquente.La prévention de ces accidents est réalisée en procédant à une remontée par paliers tels que les gaz restent en sursaturation. Des tables fixent la profondeur et la durée de la plongée. Lors de plongées rapprochées, il est tenu compte de la dénitrogénation incomplète. Enfin, il existe toujours sur les lieux de plongée professionnelle des caissons où il est possible de recomprimer rapidement le plongeur en cas d’accident. Pour toutes ces raisons, il est déconseillé de plonger seul, sans être instruit des principes élémentaires nécessaires à la plongée, et loin d’un centre médical équipé.3. PhysiopathologieL’exploration fonctionnelle respiratoire permet de mieux saisir les grands désordres physiopathologiques abordés plus loin. Elle apporte une aide diagnostique et thérapeutique aux pneumologues.L’exploration fonctionnelle respiratoireSpirométrieLe sujet étant relié à un spiromètre, on mesure les différents volumes et capacités pulmonaires (cf. Volumes pulmonaires , in chap. 1). Les résultats sont exprimés en pourcentage de la normale, à l’aide de tables tenant compte de la taille, de l’âge et du sexe du sujet. De plus, le technicien demande au sujet d’effectuer une inspiration forcée, et, tout en augmentant la vitesse de rotation du spiromètre, il l’incite à expirer le plus rapidement possible. Cela permet de mesurer le volume maximal expiré en une seconde , ou Vems (fig. 3a). Normalement, un sujet expire ainsi 75 p. 100 de sa capacité vitale (Cv). Le rapport Vems /Cv est appelé rapport de Tiffeneau .Mesure du transfert de l’oxyde de carboneLe but de cet examen est d’apprécier l’aptitude de la membrane alvéolo-capillaire à laisser passer les molécules d’oxygène dans le sang. Pour ce faire, il faudrait mesurer le nombre de millilitres d’oxygène qui traversent la membrane lorsqu’il existe une différence de pression d’oxygène de 1 torr entre le gaz alvéolaire et le sang capillaire. Malheureusement, il est impossible de prélever ce sang. On tourne la difficulté en faisant inhaler au sujet un mélange gazeux contenant une faible quantité d’oxyde de carbone (CO), gaz ayant une très forte affinité pour l’hémoglobine. On peut admettre que la pression dans le sang capillaire est nulle. Il suffit alors de mesurer la quantité d’oxyde de carbone prélevée par minute et la pression alvéolaire de ce gaz, puis de faire le rapport de ces deux valeurs. On obtient ainsi le coefficient de transfert de l’oxyde de carbone, qui est normalement de 15 ml.min-1.(mm Hg)-1. La diffusion alvéolo-capillaire étant un phénomène physique passif, le transfert de l’oxygène est proportionnel au transfert de l’oxyde de carbone.Gaz du sangEn physiopathologie respiratoire, seule est intéressante l’étude des gaz du sang des artères de la grande circulation, puisqu’elles sont situées en aval des capillaires pulmonaires. La ponction artérielle est aisée et pratiquement indolore. Sur ce sang, on mesure actuellement les pressions partielles d’oxygène et de gaz carbonique, ainsi que le pH, à l’aide d’électrodes étalonnées avec des solutions de composition connue. Des abaques permettent de calculer, à partir de ces données, la saturation du sang en oxyhémoglobine et la concentration du plasma en bicarbonates, ou réserve alcaline. L’ensemble de ces données renseigne, d’une part, sur la valeur des échanges gazeux par les pressions d’oxygène et de gaz carbonique; d’autre part, sur l’équilibre acido-basique de l’organisme, qui peut être perturbé dans les insuffisances respiratoires, mais aussi dans certaines affections métaboliques ou rénales.Les grands syndromes physiopathologiques respiratoiresSyndrome restrictifLa destruction d’une partie du parenchyme pulmonaire entraîne un syndrome restrictif. La spirométrie apprécie son importance par la valeur du rapport capacité vitale sur capacité vitale théorique (fig. 3b). La diminution de la capacité vitale peut être le fait soit d’une diminution de la capacité pulmonaire totale, comme cela se voit lors de l’ablation de tout ou partie d’un poumon, soit d’une redistribution des volumes pulmonaires, comme dans l’emphysème où le volume résiduel augmente aux dépens de la capacité vitale.Syndrome obstructifIl y a syndrome obstructif chaque fois qu’il existe une gêne à l’écoulement des gaz dans les voies aériennes. L’obstacle, qui peut sièger à différents niveaux (œdème des laryngites, corps étranger trachéobronchique fréquent chez l’enfant, cancer bronchique), entraîne une difficulté à respirer, ou dyspnée, parfois dramatique. Le syndrome obstructif de loin le plus fréquent est celui de l’asthme et surtout de la bronchite chronique.Pendant les crises d’asthme , une constriction des muscles des bronches réduit le diamètre de ces dernières. Cela est accentué pendant l’expiration qui devient longue et difficile. Le syndrome obstructif n’existe pas nécessairement dans l’intervalle des crises.La bronchite chronique est, en général, le fait de la persistance d’une infection des voies respiratoires favorisée par la pollution aérienne et le tabagisme. Les parois des bronches et des bronchioles sont le siège permanent d’un œdème qui en réduit la lumière. Il faudra déployer des pressions importantes pour mobiliser les gaz. Ces surpressions peuvent faciliter l’apparition de l’emphysème qui, schématiquement, représente la destruction des parois des alvéoles, qui se trouvent alors réunies en grands sacs où les échanges gazeux ne se font que peu ou mal.L’exploration fonctionnelle respiratoire des syndromes obstructifs est caractérisée par une diminution du rapport de Tiffeneau (fig. 3 c). Le risque de décompensation respiratoire est grand lorsque le Vems devient inférieur à 11.s-1; cela correspond pour le malade à l’impossibilité d’évacuer correctement ses sécrétions bronchiques. Dans la bronchite chronique avec emphysème, on observe l’apparition secondaire d’un syndrome restrictif avec augmentation du volume résiduel. À ce stade apparaît souvent une hypoventilation alvéolaire avec hypoxie et hypercapnie, qui vont en s’aggravant à chaque poussée de la maladie.Trouble du transfert de l’oxygèneLa qualité de la membrane alvéolo-capillaire peut se trouver altérée dans certaines affections, ou fibroses, dues à des maladies professionnelles, des cancers pulmonaires ou des maladies de nature inconnue. La caractéristique fonctionnelle de ces affections est l’apparition d’une hypoxie avec hypocapnie et d’une diminution du coefficient de transfert de l’oxyde de carbone. L’hypocapnie, qui accompagne l’hypoxie, s’explique par le fait que le gaz carbonique est vingt fois plus diffusible que l’oxygène. Il y a, dans un premier temps, une baisse de la pression partielle d’oxygène, ou hypoxie (cf. supra , chap.1), qui entraîne une hyperventilation. Celle-ci est suffisante pour augmenter le rejet du gaz carbonique et provoquer l’hypocapnie, mais ne l’est pas pour rétablir une valeur de pression partielle d’oxygène normale. Ce trouble de diffusion accompagne souvent, à des degrés divers, certaines bronchopneumopathies.
Encyclopédie Universelle. 2012.
